Wann verhält sich ein reales gas wie ein ideales gas
Inhaltsverzeichnis
- 1 Was ist ein ideales Gas?
- 2 Definition
- 3 Merkmale eines idealen Gases
- 4 Abweichungen von einem idealen Gas
- 5 Gasgesetze
- 6 Grundlagen und Eigenschaften
- 7 Unterschiede zwischen realem und idealem Gas
- 8 1. Molekulare Interaktionen
- 9 2. Volumen und Teilchendichte
- 10 3. Zustandsgleichungen
- 11 4. Energietransfer
- 12 Verhalten bei hohen Drücken und niedrigen Temperaturen
- 13 Intermolekulare Kräfte und Volumenausschluss
- 14 Intermolekulare Kräfte
- 15 Volumenausschluss
- 16 Bedingungen für ideales Gasverhalten
- 17 Temperatur und Druck
- 18 Abwesenheit von Wechselwirkungen
- 19 Beispiele für ideales Gasverhalten
- 20 1. Gleichmäßige Verteilung der Moleküle
- 21 2. Unelastische Stöße
- 22 3. Lineare Beziehung zwischen Druck und Volumen
- 23 4. Keine Phasenübergänge
- 24 5. Keine Viskosität
- 25 Gasgesetze
- 26 Boyle-Mariotte-Gesetz
- 27 Charles-Gesetz
- 28 Gay-Lussac-Gesetz
- 29 Allgemeines Gasgesetz
- 30 Avogadro-Gesetz
- 31 Van-der-Waals-Gleichung
- 32 Luft in der Atmosphäre
- 33 Praktische Anwendungen und Bedeutung
- 34 1. Gasgesetze in der Industrie
- 35 2. Gasgemische und Luft
- 36 3. Gastechnologien und Anwendungen
- 37 4. Wissenschaftliche Forschung
- 38 Chemische Reaktionen und Reaktionskinetik
- 39 Was sind chemische Reaktionen?
- 40 Reaktionsmechanismen und Reaktionskinetik
- 41 Einflussfaktoren auf die Reaktionsgeschwindigkeit
- 42 Zusammenfassung
- 43 Вопрос-ответ:
- 44 Was sind die Hauptunterschiede zwischen einem realen Gas und einem idealen Gas?
- 45 Was passiert mit einem realen Gas, wenn der Druck erhöht wird?
- 46 Wann verhält sich ein reales Gas wie ein ideales Gas?
- 47 Welche Faktoren beeinflussen das Verhalten eines realen Gases?
- 48 Warum ist es wichtig zu wissen, wie sich Gase verhalten?
- 49 Welche Rolle spielen die Van-der-Waals-Koeffizienten bei der Beschreibung des Verhaltens eines realen Gases?
- 50 Welche anderen Zustandsgleichungen werden verwendet, um das Verhalten von realen Gasen zu beschreiben?
- 51 Отзывы
Die Idee eines idealen Gases wurde erstmals von dem französischen Physiker Claude-Louis Navier im 19. Jahrhundert entwickelt. Ein ideales Gas ist ein theoretisches Konzept, bei dem Moleküle keine Volumen haben und keine zwischenmolekularen Kräfte auftreten. Diese Annahmen erlauben es, das Verhalten von Gasen mit einfachen mathematischen Modellen zu beschreiben.
Ein reales Gas hingegen besteht aus realen Molekülen, die eine bestimmte Größe und Masse besitzen und zwischen ihnen Kräfte auftreten. Diese zwischenmolekularen Kräfte, wie beispielsweise Van-der-Waals-Kräfte oder Wasserstoffbrückenbindungen, haben einen Einfluss auf das Verhalten des Gases.
Dennoch kann ein reales Gas sich unter bestimmten Bedingungen wie ein ideales Gas verhalten. Dies ist der Fall, wenn das Gas bei niedrigem Druck und hoher Temperatur vorliegt. Unter diesen Bedingungen werden die zwischenmolekularen Kräfte vernachlässigbar klein im Vergleich zur kinetischen Energie der Moleküle. Daher kann das Gas als annähernd ideal betrachtet werden.
Die Annahme eines idealen Gases ermöglicht eine einfache mathematische Beschreibung des Verhaltens, da das gasförmige Volumen proportional zur Anzahl der Moleküle und zur Temperatur ist. Es erlaubt auch die Anwendung der idealen Gasgesetz, wie das Boyle-Mariotte-Gesetz oder das Gay-Lussac-Gesetz, um das Verhalten von Gasen vorherzusagen.
In der Realität verhalten sich viele Gase jedoch nicht wie ideale Gase, vor allem bei hohen Drücken oder niedrigen Temperaturen, wo die zwischenmolekularen Kräfte dominieren. In solchen Fällen müssen komplexere Modelle, wie die van-der-Waals-Gleichung, verwendet werden, um das Verhalten von Gasen genauer zu beschreiben.
Was ist ein ideales Gas?
Definition
Ein ideales Gas ist ein hypothetisches Modell, das verwendet wird, um das Verhalten von Gasen in bestimmten physikalischen Bedingungen zu beschreiben. Es basiert auf einer Reihe von Annahmen, die es von einem realen Gas unterscheiden.
Merkmale eines idealen Gases
Ein ideales Gas wird durch verschiedene Eigenschaften charakterisiert:
- Punktförmige Teilchen: Die Teilchen eines idealen Gases werden als punktförmig betrachtet. Sie haben keine Ausdehnung und nehmen keinen Raum ein.
- Elastische Stöße: Die Teilchen eines idealen Gases stoßen untereinander und mit den Wänden des Behälters elastisch zusammen. Dabei bleibt die kinetische Energie erhalten.
- Keine Anziehungskräfte: Die Teilchen eines idealen Gases ziehen sich nicht gegenseitig an. Es gibt keine zwischenmolekularen Kräfte wie Van-der-Waals-Kräfte.
- Zufällige Bewegung: Die Teilchen eines idealen Gases bewegen sich in alle Richtungen mit unterschiedlichen Geschwindigkeiten. Ihre Bewegung ist statistisch verteilt.
Abweichungen von einem idealen Gas
In der Realität verhalten sich Gase oft nicht genau wie ideale Gase. Sie können von den idealtypischen Annahmen abweichen, zum Beispiel aufgrund von Wechselwirkungen zwischen den Teilchen oder aufgrund von Volumeneinflüssen. Unter bestimmten Bedingungen, wie niedrigem Druck und hoher Temperatur, nähert sich ein reales Gas jedoch dem Verhalten eines idealen Gases an.
Gasgesetze
Das Verhalten von Gasen, ob real oder ideal, kann durch verschiedene Gasgesetze beschrieben werden. Dazu gehören das Boyle-Mariotte-Gesetz, das Charles’sche Gesetz und das Avogadro’sche Gesetz. Diese Gesetze beschreiben die Zusammenhänge zwischen Druck, Volumen, Temperatur und Stoffmenge eines Gases.
Grundlagen und Eigenschaften
Ein reales Gas unterscheidet sich vom idealen Gas dadurch, dass es bei hohen Drücken und niedrigen Temperaturen von den idealen Gasgesetzen abweicht. Die ideale Gasgleichung PV = nRT beschreibt das Verhalten eines idealen Gases, während bei realen Gasen zusätzliche Faktoren berücksichtigt werden müssen.
Ein wichtiger Unterschied zwischen realem und idealem Gas liegt in den zwischenmolekularen Kräften. In einem idealen Gas gehen die Teilchen von völlig wechselwirkungsfrei aus, während in einem realen Gas zwischenmolekulare Anziehungskräfte vorhanden sind. Diese Anziehungskräfte führen dazu, dass reale Gase ein geringeres Volumen einnehmen als ideale Gase.
Des Weiteren ist die Kondensation ein Phänomen, das bei realen Gasen auftritt, wenn sie abgekühlt werden. Bei niedrigen Temperaturen können die zwischenmolekularen Kräfte so stark werden, dass die Gasteilchen in einen Flüssigkeitszustand übertreten. Dieses Phänomen tritt bei idealem Gas nicht auf.
Ein weiteres Merkmal, das reale Gase von idealen Gasen unterscheidet, ist die Kompressibilität. Reale Gase sind kompressibler als ideale Gase, da die zwischenmolekularen Kräfte das Zusammenziehen des Gases beeinflussen. Dadurch nimmt das Volumen eines realen Gases unter Druck ab, während das Volumen eines idealen Gases unverändert bleibt.
Zusammenfassend verhält sich ein reales Gas im Vergleich zu einem idealen Gas anders, da zwischenmolekulare Kräfte und Kondensation eine Rolle spielen. Reale Gase nehmen ein geringeres Volumen ein, sind kompressibler und können in Flüssigkeiten übergehen. Diese Unterschiede in den Eigenschaften beruhen auf den zwischenmolekularen Wechselwirkungen, die bei idealen Gasen vernachlässigbar sind.
Unterschiede zwischen realem und idealem Gas
1. Molekulare Interaktionen
Ein wesentlicher Unterschied zwischen einem realen Gas und einem idealen Gas sind die molekularen Interaktionen. In einem idealen Gas werden die Gasmoleküle als punktförmige Teilchen betrachtet, die keine Wechselwirkungen miteinander haben. Diese Annahme erlaubt einfache Berechnungen und vereinfacht die mathematischen Modelle.
Im Gegensatz dazu interagieren die Moleküle in einem realen Gas aufgrund der zwischenmolekularen Kräfte miteinander. Diese Kräfte können anziehender oder abstoßender Natur sein und müssen bei der Modellierung des Verhaltens eines realen Gases berücksichtigt werden. Diese Wechselwirkungen führen zu Abweichungen von den idealen Gasgesetzen, insbesondere bei hohen Drücken oder niedrigen Temperaturen.
2. Volumen und Teilchendichte
Ein weiterer Unterschied zwischen realen und idealen Gasen liegt im Volumen und in der Teilchendichte. In einem idealen Gas nehmen die Gasmoleküle keinen Raum ein und werden als Punktmasse betrachtet. Daher kann das Volumen eines idealen Gases vernachlässigt werden, was die Berechnungen vereinfacht.
Im Gegensatz dazu nehmen die Moleküle in einem realen Gas ein gewisses Volumen ein. Dies führt dazu, dass das Volumen eines realen Gases größer ist als das Volumen, das das ideale Gas einnehmen würde, wenn es die gleiche Anzahl von Molekülen hätte. Darüber hinaus ist die Teilchendichte in einem realen Gas höher als in einem idealen Gas aufgrund der Molekülwechselwirkungen.
3. Zustandsgleichungen
Die Zustandsgleichungen für ein ideales und ein reales Gas unterscheiden sich ebenfalls. Die Zustandsgleichung für ein ideales Gas ist die ideale Gasgleichung, die den idealen gasgesetzlichen Zusammenhang zwischen Druck, Volumen, Temperatur und der Anzahl der Gaspartikel beschreibt.
Für reale Gase werden dagegen komplexere Zustandsgleichungen verwendet, die die molekularen Wechselwirkungen berücksichtigen. Beispiele dafür sind die Van-der-Waals-Gleichung und die Redlich-Kwong-Gleichung. Diese Gleichungen umfassen Korrekturfaktoren, um die Abweichungen eines realen Gases von einem idealen Gas zu berücksichtigen.
4. Energietransfer
Ein weiterer Unterschied zwischen einem realen und einem idealen Gas besteht im Energietransfer. In einem idealen Gas werden keine Energieverluste durch Reibung oder Wärmeleitung berücksichtigt. Dies ermöglicht eine einfache Berechnung der Energiebilanz.
In einem realen Gas gibt es jedoch Energieverluste aufgrund von Reibung zwischen den Gasmolekülen und Wärmeleitung durch die Wände des Behälters. Diese Energieverluste führen zu Abweichungen vom idealen Verhalten und müssen bei der Modellierung eines realen Gases berücksichtigt werden.
Verhalten bei hohen Drücken und niedrigen Temperaturen
Bei hohen Drücken und niedrigen Temperaturen verhält sich ein reales Gas anders als ein ideales Gas. In einem idealen Gas nehmen die Gasteilchen kein Volumen ein und üben keine Wechselwirkung untereinander aus. Dies führt dazu, dass das ideale Gasgesetz, welches den Zusammenhang zwischen Druck, Volumen und Temperatur beschreibt, uneingeschränkt gültig ist.
Bei hohen Drücken und niedrigen Temperaturen können jedoch die Annahmen des idealen Gasgesetzes nicht mehr erfüllt sein. Reale Gase bestehen aus Molekülen, die eine gewisse Größe haben und somit ein Volumen einnehmen. Durch den hohen Druck und die niedrige Temperatur werden die Teilchen enger zusammengepresst und es treten Wechselwirkungen zwischen den Molekülen auf.
Diese Wechselwirkungen führen dazu, dass sich reale Gase bei hohen Drücken und niedrigen Temperaturen anders verhalten als ideale Gase. Die Teilchen können nicht mehr frei im Raum verteilt werden und die Molvolumina nehmen an Bedeutung zu. Das Volumen des Gases wird kleiner und der Druck steigt schneller an als bei einem idealen Gas.
Zudem können bei diesen Bedingungen auch Phänomene wie Kondensation und Sublimation auftreten. Wenn die Temperatur niedrig genug ist, können die Gasteilchen in einen flüssigen oder sogar festen Zustand übergehen. Dies führt zu weiteren Abweichungen vom idealen Gasverhalten.
Um das Verhalten realer Gase bei hohen Drücken und niedrigen Temperaturen besser zu beschreiben, wurden verschiedene erweiterte Gasgesetze entwickelt. Diese berücksichtigen die Molekülgröße, die Wechselwirkungen und andere Faktoren und ermöglichen eine genauere Berechnung der Gaszustände unter diesen Bedingungen.
Insgesamt kann man sagen, dass sich reale Gase bei hohen Drücken und niedrigen Temperaturen aufgrund von Molekülvolumen und Wechselwirkungen anders verhalten als ideale Gase. Die Annahmen des idealen Gasgesetzes gelten nicht mehr und erweiterte Gasgesetze werden benötigt, um das Verhalten realer Gase unter diesen Bedingungen zu beschreiben.
Intermolekulare Kräfte und Volumenausschluss
Reale Gase verhalten sich anders als ideale Gase aufgrund der Existenz von intermolekularen Kräften und dem Effekt des Volumenausschlusses.
Intermolekulare Kräfte
Intermolekulare Kräfte sind die Anziehungskräfte zwischen den Molekülen eines Gases. Diese Kräfte können verschiedener Natur sein, wie beispielsweise Van-der-Waals-Kräfte, Dipol-Dipol-Wechselwirkungen oder Wasserstoffbrückenbindungen. Im Gegensatz zu idealen Gasen, bei denen keine intermolekularen Kräfte vorhanden sind, wirken diese Kräfte bei realen Gasen.
Die intermolekularen Kräfte führen zu einer Verringerung der kinetischen Energie der Gasmoleküle, da ein Teil der Energie für die Überwindung der Anziehungskräfte aufgewendet werden muss. Dadurch verringert sich die Geschwindigkeit der Gasmoleküle und damit auch der Druck des Gases. Dieser Effekt wird als Van-der-Waals-Korrektur bezeichnet.
Volumenausschluss

Ein weiterer Faktor, der das Verhalten realer Gase von idealen Gasen unterscheidet, ist der Volumenausschluss. Moleküle nehmen ein bestimmtes Volumen ein und können sich nicht an einem Ort befinden, an dem sich bereits ein anderes Molekül befindet. Dieser Effekt führt dazu, dass reale Gase ein größeres Volumen einnehmen als ideale Gase bei gleicher Temperatur und Druck.
Der Volumenausschluss führt dazu, dass reale Gase in der Realität nie das ideale Gasgesetz perfekt erfüllen. Wenn die Gasmoleküle sehr eng beieinander liegen, wie es zum Beispiel bei hohen Drücken der Fall ist, wird der Volumeneffekt immer relevanter. Bei niedrigen Drücken hingegen nähern sich reale Gase dem Verhalten idealer Gase an.
Um das Verhalten realer Gase zu modellieren, wurden verschiedene Zustandsgleichungen entwickelt, die die Einflüsse der intermolekularen Kräfte und des Volumenausschlusses berücksichtigen. Bekannte Beispiele sind die Van-der-Waals-Gleichung oder die Redlich-Kwong-Gleichung.
Bedingungen für ideales Gasverhalten
Ein reales Gas verhält sich unter bestimmten Bedingungen wie ein ideales Gas. Diese Bedingungen sind:
- Hohe Temperaturen: Ideales Gasverhalten tritt am besten bei hohen Temperaturen auf. Je höher die Temperatur, desto geringer sind die Anziehungskräfte zwischen den Gaspartikeln und desto stärker dominieren die kinetischen Eigenschaften.
- Geringer Druck: Ideales Gasverhalten zeigt sich auch bei geringem Druck. Bei niedrigem Druck sind die Abstände zwischen den Gasteilchen groß im Vergleich zu ihrer Größe, so dass die molekularen Wechselwirkungen vernachlässigbar sind.
- Moderate Dichte: Ideales Gasverhalten wird bei mäßiger Dichte beobachtet. Wenn die Gasteilchen zu dicht zusammenliegen, nehmen die molekularen Wechselwirkungen zu und das Verhalten des Gases ist nicht mehr ideal.
- Keine chemischen Reaktionen: Ideales Gasverhalten tritt nur auf, wenn keine chemischen Reaktionen zwischen den Gaspartikeln stattfinden. Wenn es zu chemischen Reaktionen kommt, ändern sich die Eigenschaften des Gases und es verhält sich nicht mehr nach den Gesetzen der idealen Gase.
Unter diesen Bedingungen können die idealen Gasgesetze angewendet werden, wie das Boyle-Mariotte-Gesetz, das Charles-Gesetz und das Avogadro-Gesetz. Diese Gesetze beschreiben das Verhalten von idealen Gasen und geben Zusammenhänge zwischen Druck, Volumen, Temperatur und Stoffmenge an.
Temperatur und Druck

Die Temperatur und der Druck sind zwei wichtige Faktoren, die das Verhalten eines realen Gases bestimmen. Sie sind eng miteinander verbunden und beeinflussen sich gegenseitig.
Die Temperatur eines Gases ist ein Maß für die kinetische Energie der Gasmoleküle. Je höher die Temperatur, desto schneller bewegen sich die Moleküle und desto größer ist ihre kinetische Energie. Dies führt zu einer höheren Druckausübung auf die Wände des Behälters, in dem sich das Gas befindet.
Der Druck eines Gases entsteht durch die Kollision der Gasmoleküle mit den Wänden des Behälters. Je häufiger und stärker die Kollisionen sind, desto höher ist der Druck. Der Druck eines idealen Gases folgt der idealen Gasgleichung pV = nRT, in der p der Druck, V das Volumen, n die Anzahl der Gasmoleküle, R die Gaskonstante und T die Temperatur ist.
Bei hohen Temperaturen und niedrigem Druck verhält sich ein reales Gas mehr wie ein ideales Gas. Dies liegt daran, dass bei hohen Temperaturen die kinetische Energie der Gasmoleküle groß genug ist, um die zwischenmolekularen Kräfte zu überwinden und das Gas in einem freien Zustand zu halten. Bei niedrigem Druck sind die zwischenmolekularen Kräfte ebenfalls geringer und haben daher weniger Einfluss auf das Verhalten des Gases.
Insgesamt lässt sich feststellen, dass das Verhalten eines realen Gases in der Regel näherungsweise dem eines idealen Gases entspricht, wenn die Temperatur hoch und der Druck niedrig ist.
Abwesenheit von Wechselwirkungen
Eine der Bedingungen, unter denen sich ein reales Gas wie ein ideales Gas verhält, ist die Abwesenheit von Wechselwirkungen zwischen den Gaspartikeln. In einem idealen Gas nehmen die Gasteilchen keinerlei Rücksicht aufeinander und interagieren nicht miteinander. Das bedeutet, dass sie sich nicht anziehen oder abstoßen und keine Energie oder Impuls austauschen.
Im Gegensatz dazu wechselwirken die Teilchen eines realen Gases miteinander. Sie können sich gegenseitig anziehen oder abstoßen, und es findet ein Austausch von Energie und Impuls statt. Diese Wechselwirkungen können dazu führen, dass sich das reale Gas von einem idealen Gas unterscheidet.
Bei niedrigen Drücken und hohen Temperaturen sind die Wechselwirkungen zwischen den Gasteilchen jedoch vernachlässigbar gering. Die Teilchen haben genug Bewegungsenergie, um sich von den Anziehungskräften der anderen Teilchen zu distanzieren. Unter diesen Bedingungen verhalten sich reale Gase annähernd wie ideale Gase.
Wenn die Annahme der Abwesenheit von Wechselwirkungen gilt, lassen sich viele Berechnungen und Formeln für ideale Gase verwenden, um das Verhalten realer Gase näherungsweise zu beschreiben. Dieser Ansatz ist in vielen Anwendungen der Thermodynamik und der Gasgesetze sehr nützlich.
Beispiele für ideales Gasverhalten
1. Gleichmäßige Verteilung der Moleküle
Ein ideales Gas verhält sich wie ein ideales Gas, wenn die Moleküle gleichmäßig im Raum verteilt sind. Das bedeutet, dass die Moleküle sich frei bewegen und keine Vorliebe für eine bestimmte Region haben. Dieses Verhalten kann beobachtet werden, wenn das Gas in einem Behälter eingeschlossen ist und sich die Moleküle frei im Behälter bewegen können.
2. Unelastische Stöße
Ein ideales Gas verhält sich wie ein ideales Gas, wenn die Stöße zwischen den Molekülen als vollständig unelastisch betrachtet werden können. Bei einem unelastischen Stoß verlieren die Moleküle des Gases keine kinetische Energie und behalten ihre ursprüngliche Geschwindigkeit bei. Dieses Verhalten ist typisch für idealisierte Gase, in denen die Moleküle keine Anziehungskräfte oder andere Wechselwirkungen haben.
3. Lineare Beziehung zwischen Druck und Volumen
Eine weitere charakteristische Eigenschaft eines idealen Gases ist die lineare Beziehung zwischen Druck und Volumen, die durch das Gesetz von Boyle-Mariotte beschrieben wird. Laut diesem Gesetz ist das Produkt aus Druck und Volumen eines idealen Gases konstant, wenn die Temperatur konstant ist. Das bedeutet, dass sich das Volumen des Gases proportional zum umgekehrten Druck ändert.
4. Keine Phasenübergänge

Ein ideales Gas verhält sich wie ein ideales Gas, wenn es keine Phasenübergänge gibt. Das bedeutet, dass das Gas nicht kondensiert, verdampft oder sublimiert, wenn seine Temperatur oder der Druck verändert wird. In der Realität können reale Gase diese Phasenübergänge bei bestimmten Bedingungen erfahren, aber idealisierte Gase werden von diesen Effekten nicht beeinflusst.
5. Keine Viskosität
Ein weiteres Beispiel für ideales Gasverhalten ist das Fehlen von Viskosität. Viskosität ist die Fähigkeit eines Stoffes, widerstandsfähig gegen das Fließen zu sein. Ideale Gase haben keine Viskosität, was bedeutet, dass sie sich ohne jeglichen Widerstand durch einen Schlauch oder ein Rohr bewegen können. Dieses Verhalten ermöglicht es idealen Gasen, sich schnell und effizient auszubreiten.
Insgesamt können ideale Gase anhand dieser Eigenschaften definiert werden. Obwohl es in der Realität keine perfekten idealen Gase gibt, helfen diese Idealannahmen den Wissenschaftlern, das Verhalten von Gasen unter bestimmten Bedingungen besser zu verstehen und mathematisch zu modellieren.
Gasgesetze
Boyle-Mariotte-Gesetz

Das Boyle-Mariotte-Gesetz besagt, dass bei konstanter Temperatur das Produkt aus Druck und Volumen eines Gases konstant ist. Das bedeutet, dass sich das Volumen eines Gases umgekehrt proportional zu seinem Druck verhält. Wenn der Druck steigt, verringert sich das Volumen und umgekehrt.
Charles-Gesetz
Das Charles-Gesetz beschreibt das Verhältnis zwischen der Temperatur und dem Volumen eines Gases bei konstantem Druck. Es besagt, dass das Volumen eines Gases proportional zur Temperatur ist. Wenn die Temperatur steigt, dehnt sich das Gas aus und umgekehrt.
Gay-Lussac-Gesetz

Das Gay-Lussac-Gesetz besagt, dass bei konstantem Volumen das Verhältnis zwischen Druck und Temperatur eines Gases konstant ist. Das bedeutet, dass der Druck eines Gases proportional zur Temperatur ist. Wenn die Temperatur steigt, steigt auch der Druck und umgekehrt.
Allgemeines Gasgesetz

Das allgemeine Gasgesetz verbindet die drei genannten Gesetze miteinander. Es besagt, dass das Produkt aus Druck, Volumen und Temperatur eines Gases konstant ist. Dies bedeutet, dass sich das Volumen eines Gases umgekehrt proportional zum Druck verhält und direkt proportional zur Temperatur.
Avogadro-Gesetz
Das Avogadro-Gesetz besagt, dass bei konstantem Druck und konstanter Temperatur das Volumen eines Gases proportional zur Anzahl der Teilchen ist. Je mehr Teilchen vorhanden sind, desto größer ist das Volumen des Gases.
Van-der-Waals-Gleichung
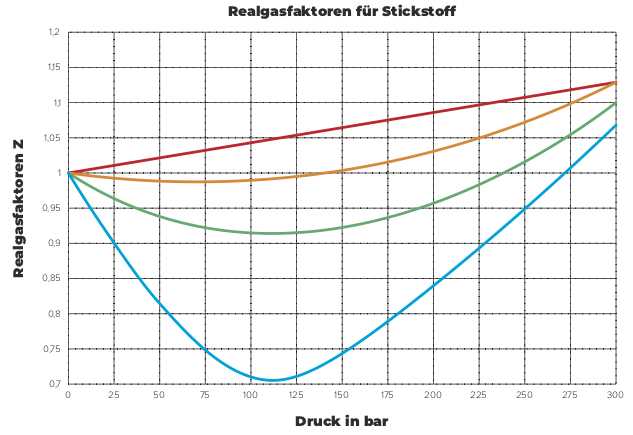
Die Van-der-Waals-Gleichung ist eine Erweiterung des idealen Gasgesetzes, das die Wechselwirkungen zwischen den Teilchen eines realen Gases berücksichtigt. Sie berücksichtigt die Volumen- und Wechselwirkungsparameter, die bei hohem Druck und niedriger Temperatur signifikant werden.
Luft in der Atmosphäre
Die Luft in der Atmosphäre besteht aus einer Mischung verschiedener Gase, die für das Leben auf der Erde von entscheidender Bedeutung sind. Das Hauptgas der Luft ist Stickstoff, der ungefähr 78 Prozent des Volumens ausmacht. Daneben enthält die Luft auch etwa 21 Prozent Sauerstoff, der für das Atmen und die Verbrennung notwendig ist.
Ein weiteres wichtiges Gas in der Atmosphäre ist Kohlendioxid. Es macht nur einen kleinen Anteil von etwa 0,04 Prozent aus, spielt aber eine entscheidende Rolle im Klimasystem der Erde. Kohlendioxid ist ein Treibhausgas, das dazu beiträgt, dass die Erde Wärme speichern kann. In den letzten Jahrzehnten ist der Kohlendioxidgehalt in der Atmosphäre aufgrund menschlicher Aktivitäten deutlich angestiegen und trägt somit zum Klimawandel bei.
Neben diesen Hauptbestandteilen enthält die Luft auch andere Gase wie Argon, Neon, Helium, Methan und Wasserstoff. Diese Gase machen zusammen nur einen sehr kleinen Teil der Atmosphäre aus, aber sie sind dennoch wichtig für verschiedene physikalische und chemische Prozesse.
Zusätzlich zu den Gasen enthält die Luft auch winzige Partikel wie Staub, Pollen, Rauch und Aerosole. Diese Partikel können sowohl natürlichen Ursprungs sein als auch durch menschliche Aktivitäten wie Verbrennung von fossilen Brennstoffen oder industrielle Emissionen entstehen. Sie haben Auswirkungen auf die Luftqualität und können sowohl positive als auch negative Effekte haben, je nach Art und Konzentration der Partikel.
Insgesamt ist die Luft in der Atmosphäre ein komplexes Gemisch aus Gasen, das nicht nur für das Leben auf der Erde, sondern auch für verschiedene physikalische und chemische Prozesse von großer Bedeutung ist. Die Zusammensetzung und Eigenschaften der Luft werden durch natürliche und menschliche Aktivitäten beeinflusst und können Auswirkungen auf die Umwelt und den Klimawandel haben.
Praktische Anwendungen und Bedeutung

1. Gasgesetze in der Industrie
Die Kenntnis der Gasgesetze und die Möglichkeit, Gase als ideale Gase zu modellieren, spielen eine wichtige Rolle in der Industrie. Sie ermöglichen die präzise Berechnung von Druck, Volumen und Temperatur in verschiedenen Anwendungsbereichen wie der Gasverdichtung, der Gaslagerung und der Versorgung mit industriellen Gasen. Durch das Verhalten idealer Gase können Ingenieure und Techniker die Eigenschaften von Gasen vorhersagen und effiziente Prozesse entwickeln.
2. Gasgemische und Luft
Die Annahme, dass ein reales Gas sich wie ein ideales Gas verhält, ist auch für die Erforschung von Gasgemischen, insbesondere der Luft, von Bedeutung. Die Luft besteht aus verschiedenen Gasen wie Stickstoff, Sauerstoff, Kohlendioxid und Wasserdampf. Indem man die Gasgesetze auf diese Mischungen anwendet, kann man Veränderungen der Zusammensetzung, des Drucks und der Temperatur besser verstehen und analysieren. Dies ist wichtig für die Bereiche der Umweltforschung, der Atmosphärenchemie und der Verbrennungsprozesse.
3. Gastechnologien und Anwendungen
Die Anwendung idealer Gasgesetze ist auch in vielen Bereichen der Gastechnologie von großer Bedeutung. Beispielsweise wird bei der Entwicklung von Gasturbinen, Gastrennungsverfahren und Gasreinigungstechnologien das Verhalten von Gasen unter verschiedenen Bedingungen berücksichtigt. Die Modellierung von Gasen als ideale Gase ermöglicht es Ingenieuren, Betriebsbedingungen zu optimieren, Effizienz zu steigern und Sicherheitsaspekte zu berücksichtigen.
4. Wissenschaftliche Forschung
Die Annahme eines idealen Gasverhaltens hat auch in der wissenschaftlichen Forschung viele Anwendungen. In der Chemie und Physik ermöglicht die Verwendung von idealen Gasgesetzen die Vorhersage von Reaktionsbedingungen und die Berechnung von Stoffmengen und Konzentrationen. Dies ist wichtig bei der Entwicklung neuer Materialien, Katalysatoren und Medikamente. Darüber hinaus dient die Modellierung von Gasen als ideale Gase als Grundlage für weiterführende Forschungen und Experimente.
Insgesamt haben die praktischen Anwendungen des idealen Gasgesetzes eine große Bedeutung in verschiedenen Bereichen der Industrie, Forschung und Technologie. Sie ermöglichen präzise Berechnungen, das Verständnis von Gasgemischen und die Entwicklung effizienter Prozesse. Die Annahme eines idealen Gasverhaltens ist ein wertvolles Werkzeug für Ingenieure, Wissenschaftler und Techniker, um das Verhalten von Gasen besser zu verstehen und zu nutzen.
Chemische Reaktionen und Reaktionskinetik
Was sind chemische Reaktionen?

Chemische Reaktionen sind Umwandlungen von chemischen Stoffen in andere Stoffe. Dabei werden chemische Bindungen zwischen den Atomen gebrochen und neue Bindungen gebildet. Die Stoffe vor der Reaktion nennt man Edukte oder Reaktanten, und die Stoffe nach der Reaktion nennt man Produkte.
Chemische Reaktionen laufen nach bestimmten Reaktionsmechanismen ab. Die Reaktionskinetik beschäftigt sich mit der Untersuchung der Geschwindigkeit von chemischen Reaktionen und den Faktoren, die diese Geschwindigkeit beeinflussen.
Reaktionsmechanismen und Reaktionskinetik
Reaktionsmechanismen sind detaillierte Beschreibungen des Ablaufs einer chemischen Reaktion auf atomarer oder molekularer Ebene. Sie beschreiben, wie die Edukte zu den Produkten umgesetzt werden, und können aus mehreren einzelnen Reaktionsschritten bestehen.
Die Reaktionskinetik untersucht die Geschwindigkeit einer chemischen Reaktion und die Faktoren, die diese Geschwindigkeit beeinflussen. Dazu gehören beispielsweise die Konzentration der Edukte, die Temperatur, der Druck oder auch das Vorhandensein von Katalysatoren. Die Reaktionskinetik ermöglicht es, die Geschwindigkeit von chemischen Reaktionen zu messen und zu steuern.
Einflussfaktoren auf die Reaktionsgeschwindigkeit
Die Geschwindigkeit einer chemischen Reaktion kann durch verschiedene Faktoren beeinflusst werden. Dazu gehören unter anderem die Konzentration der Edukte, die Temperatur, der Druck oder das Vorhandensein von Katalysatoren.
Erhöht man die Konzentration der Edukte, wird die Wahrscheinlichkeit für Zusammenstöße zwischen den Molekülen erhöht, was zu einer schnelleren Reaktion führt. Eine Erhöhung der Temperatur erhöht ebenfalls die Geschwindigkeit, da die Teilchen bei höherer Temperatur eine größere kinetische Energie haben und deshalb häufiger zusammenstoßen.
Der Druck beeinflusst die Reaktion vor allem bei gasförmigen Edukten. Eine Erhöhung des Drucks führt dazu, dass die Gasteilchen enger zusammengepresst sind und somit häufiger zusammenstoßen.
Katalysatoren sind Substanzen, die die Reaktionsgeschwindigkeit beschleunigen, indem sie den Reaktionsmechanismus verändern. Sie werden am Ende einer Reaktion unverändert wiedergewonnen und können daher mehrere Reaktionen katalysieren.
Zusammenfassung
Chemische Reaktionen sind Umwandlungen von chemischen Stoffen in andere Stoffe. Die Reaktionsmechanismen beschreiben den Ablauf einer chemischen Reaktion auf atomarer oder molekularer Ebene. Die Reaktionskinetik untersucht die Geschwindigkeit von chemischen Reaktionen und die Faktoren, die diese Geschwindigkeit beeinflussen. Zu diesen Faktoren gehören unter anderem die Konzentration der Edukte, die Temperatur, der Druck und das Vorhandensein von Katalysatoren.
Вопрос-ответ:
Was sind die Hauptunterschiede zwischen einem realen Gas und einem idealen Gas?
Ein reales Gas unterscheidet sich von einem idealen Gas in mehreren Aspekten. Ein ideales Gas wird als eine ideale Mischung von Gaspartikeln betrachtet, die keine Eigenvolumen haben und miteinander nicht wechselwirken. Es gehorcht perfekt den Boyle-Mariotte, Gay-Lussac, und Avogadro-Gesetzen. Im Gegensatz dazu haben reale Gase ein Eigenvolumen und es treten zwischen den Gaspartikeln Wechselwirkungen auf. Diese Abweichungen führen dazu, dass die Gasgesetze nur für ideale Gase exakt gelten, während reale Gase bei hohen Drücken und niedrigen Temperaturen von den idealen Gasgesetzen abweichen.
Was passiert mit einem realen Gas, wenn der Druck erhöht wird?
Wenn der Druck auf ein reales Gas erhöht wird, werden die Gaspartikel enger zusammengepresst und die zwischen ihnen auftretenden Attraktionskräfte werden stärker. Dadurch nimmt das Volumen des realen Gases ab. Bei hohen Drücken kann es sogar zu Kondensation übergehen und vom gasförmigen Zustand in den flüssigen Zustand übergehen.
Wann verhält sich ein reales Gas wie ein ideales Gas?
Ein reales Gas verhält sich näherungsweise wie ein ideales Gas, wenn der Druck niedrig und die Temperatur hoch ist. Bei niedrigen Drücken und hohen Temperaturen werden die zwischen den Gaspartikeln auftretenden Wechselwirkungen vernachlässigbar klein und das Gasverhalten kann mit den idealen Gasgesetzen gut beschrieben werden.
Welche Faktoren beeinflussen das Verhalten eines realen Gases?
Das Verhalten eines realen Gases wird durch mehrere Faktoren beeinflusst. Dazu gehören der Druck, die Temperatur, das Volumen, die Anziehungskräfte zwischen den Gaspartikeln sowie die Masse der Gaspartikel. Diese Faktoren sorgen dafür, dass sich reale Gase von idealen Gasen unterscheiden und dass die idealen Gasgesetze nur eine Vereinfachung der Realität darstellen.
Warum ist es wichtig zu wissen, wie sich Gase verhalten?
Es ist wichtig zu wissen, wie sich Gase verhalten, um ihre physikalischen und chemischen Eigenschaften besser zu verstehen und um Prozesse und Reaktionen in der Chemie, Physik und Technik besser beschreiben zu können. Das Verhalten von Gasen hat direkte Auswirkungen auf viele industrielle Prozesse, wie zum Beispiel die Herstellung von Gasen, die Lagerung und der Transport von Gasen sowie die Verbrennung von Gasen. Darüber hinaus sind Gase auch in vielen alltäglichen Situationen präsent, wie zum Beispiel beim Atmen, beim Kochen oder bei der Klimatisierung von Räumen.
Welche Rolle spielen die Van-der-Waals-Koeffizienten bei der Beschreibung des Verhaltens eines realen Gases?
Die Van-der-Waals-Koeffizienten spielen eine wichtige Rolle bei der Beschreibung des Verhaltens eines realen Gases. Sie berücksichtigen die zwischen den Gaspartikeln auftretenden Attraktions- und Abstoßungskräfte, die bei idealen Gasen vernachlässigt werden. Die Van-der-Waals-Koeffizienten ermöglichen es, das Verhalten von realen Gasen genauer zu beschreiben und Abweichungen von den idealen Gasgesetzen zu erklären.
Welche anderen Zustandsgleichungen werden verwendet, um das Verhalten von realen Gasen zu beschreiben?
Neben der idealen Gasgleichung gibt es noch weitere Zustandsgleichungen, die verwendet werden, um das Verhalten von realen Gasen zu beschreiben. Dazu gehören die Van-der-Waals-Gleichung, die Redlich-Kwong-Gleichung, die Peng-Robinson-Gleichung und die Soave-Redlich-Kwong-Gleichung. Diese Zustandsgleichungen berücksichtigen verschiedene Faktoren, wie zum Beispiel das Eigenvolumen der Gaspartikel oder die zwischen ihnen auftretenden Wechselwirkungen, und ermöglichen eine genauere Beschreibung des Gasverhaltens als die ideale Gasgleichung.
Отзывы
Max Müller
Ein reales Gas verhält sich wie ein ideales Gas, wenn die Teilchen des Gases weit voneinander entfernt sind und wenig miteinander wechselwirken. Dies tritt in der Regel bei niedrigem Druck und hoher Temperatur auf. In diesem Zustand können die Gesetze der idealen Gase, wie zum Beispiel das ideale Gasgesetz, angewendet werden, um das Verhalten des Gases zu beschreiben. Für einen männlichen Leser könnte dieses Thema von Interesse sein, da es Einblick in die physikalischen Eigenschaften von Gasen und deren Verhalten unter bestimmten Bedingungen gibt. Dieses Wissen kann in verschiedenen Bereichen wie Chemie, Energie oder Technik von Nutzen sein. Darüber hinaus kann es auch helfen, das Verhalten von Gasen im Alltag besser zu verstehen, zum Beispiel beim Kochen oder in der Autoindustrie. Insgesamt ist es interessant zu erfahren, wie sich Gase verhalten und warum sie sich in bestimmten Fällen wie ideale Gase verhalten, da dies unser Verständnis der Physik und Chemie erweitert.
Sarah Schmidt
Als weibliche Leserin bin ich fasziniert von dem Thema „Wann verhält sich ein reales Gas wie ein ideales Gas“. Es ist erstaunlich, wie sich Gase in der Realität verhalten und wie wir sie durch das Konzept des idealen Gases verstehen können. Reale Gase verhalten sich dann wie ideale Gase, wenn ihre Partikelabstände im Vergleich zum Durchmesser der Partikel sehr groß sind. Außerdem müssen die Teilchen ständig in zufälliger Bewegung sein und miteinander kollidieren. Diese Kollisionen sollten elastisch sein, was bedeutet, dass keine Energie verloren geht. Diese Bedingungen ermöglichen es uns, reale Gase mit dem ideellen Gasmodell zu beschreiben. Ich finde es faszinierend, wie wir mithilfe von Formeln wie der idealen Gasgleichung den Druck, das Volumen und die Temperatur von Gasen berechnen können. Es ist erstaunlich, wie genau diese Gleichung funktioniert, wenn die Bedingungen für ein ideales Gas erfüllt sind. Es ist wichtig zu verstehen, dass die meisten Gase in der Realität nicht wirklich ideale Gase sind. Sie zeigen Abweichungen von den idealen Gasgesetzen aufgrund von verschiedenen Faktoren wie Molekülgröße, zwischenmolekularen Kräften und unelastischen Kollisionen. Diese Abweichungen können bei hohen Drücken oder niedrigen Temperaturen besonders signifikant sein. Ich finde es spannend, wie Wissenschaftler diese Abweichungen erforschen, um ein besseres Verständnis von realen Gasen zu bekommen. Indem sie die Eigenschaften von verschiedenen Gasen untersuchen, können sie Modelle und Theorien entwickeln, die uns helfen, das Verhalten von Gasen zu verstehen und vorherzusagen. Insgesamt finde ich das Thema „Wann verhält sich ein reales Gas wie ein ideales Gas“ sehr interessant und es eröffnet mir eine neue Perspektive auf die Welt der Gase. Es ist erstaunlich, wie wir diese unsichtbaren Substanzen durch mathematische Modelle beschreiben und verstehen können.
Lena Wagner
Hallo! Ich finde den Artikel sehr interessant. Als Frau interessiere ich mich zwar nicht besonders für Gasgesetze, aber es ist gut zu wissen, warum ein reales Gas sich manchmal wie ein ideales Gas verhält. Es ist faszinierend zu erfahren, dass ein ideales Gas bestimmte Annahmen erfüllt, wie etwa dass die Teilchen keinen Platz einnehmen und keine Wechselwirkungen haben. Aber in der Realität haben die Gasteilchen natürlich ein Volumen und können miteinander interagieren. Deshalb ist es wichtig, die Eigenschaften eines realen Gases zu verstehen und zu wissen, wann es sich wie ein ideales Gas verhält. Ich finde es beeindruckend, dass Forscher mathematische Modelle entwickelt haben, um das Verhalten realer Gase zu beschreiben und zu berechnen. Es ist toll, dass man in der Lage ist, diese Modelle zu nutzen, um verschiedene physikalische Phänomene zu erklären und vorherzusagen, wie sich Gase in bestimmten Situationen verhalten. Insgesamt finde ich den Artikel informativ und gut erklärt. Vielen Dank für die interessante Lektüre!